

朗来科技自主研发的1类创新药首次公布临床结果
-
发布日期2024-12-02
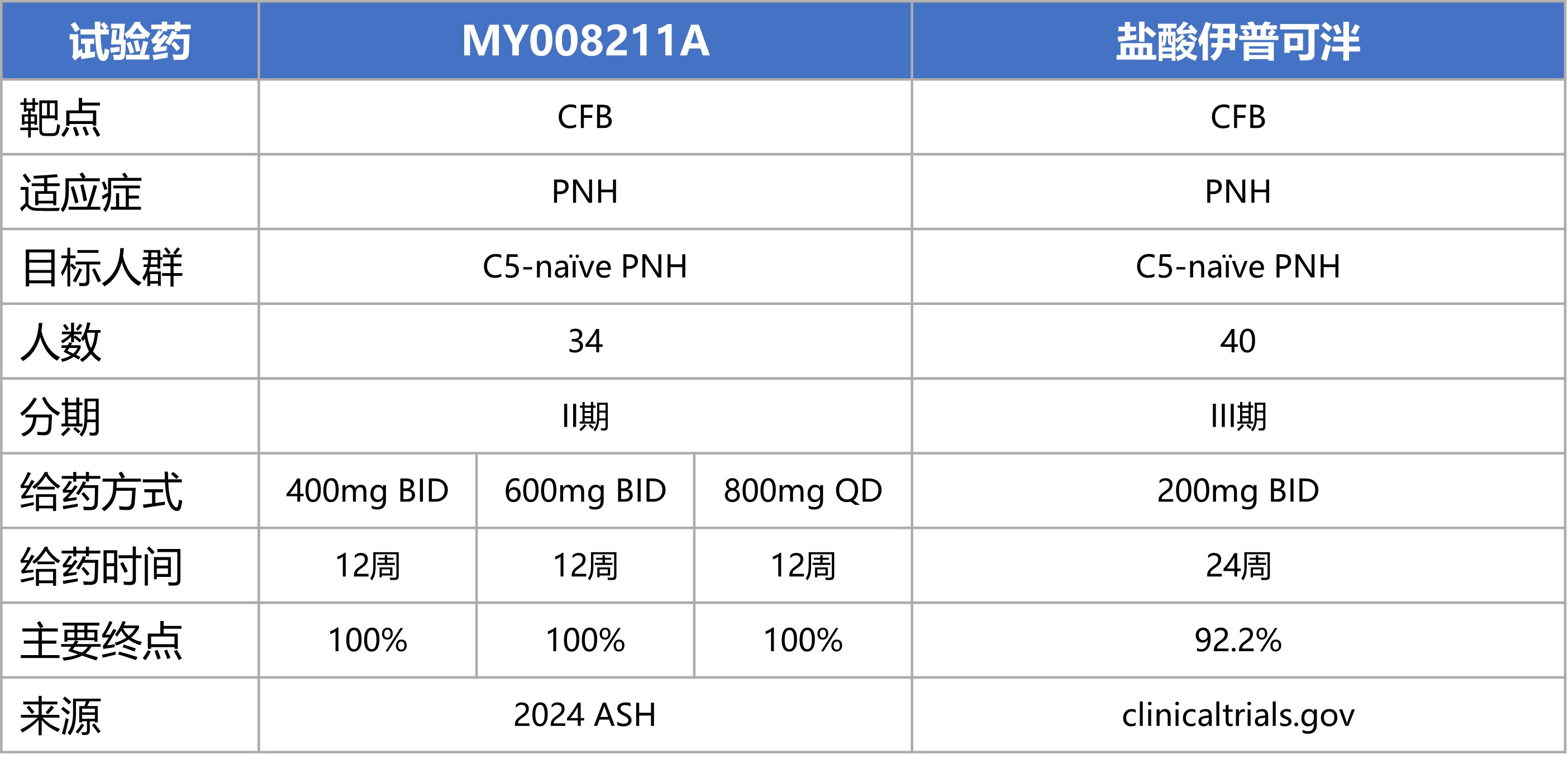
2024年美国血液学会(ASH)年会将于当地时间12月7日至10日间在美国圣地亚哥举行,目前摘要已经公布。武汉朗来科技发展有限公司的1类新药 MY008211A 将在本次ASH会议上公布一项单药治疗未接受补体抑制剂治疗的阵发性睡眠性血红蛋白尿(PNH)患者的II期临床研究结果。

MY008211A是由武汉朗来科技发展有限公司(简称:朗来科技)自主研发的化学药1类新药,是一种补体B因子(CFB)抑制剂。CFB是补体旁路途径(AP)的正向调节因子,MY008211A通过特异性结合B因子,抑制补体旁路途径中CFB的活性,抑制AP和AP通路中的正反馈放大环路,从而抑制C3和C5转化酶的形成,最终改善血管内溶血,无血管外溶血风险。MY008211A单药治疗未接受补体抑制剂治疗的PNH和接受补体抑制剂治疗的PNH患者的两项III期临床研究正在进行中。此外,朗来科技MY008211A片治疗IgA肾病的临床II期研究已启动,开始入组。拟开发原发性膜性肾病、非典型溶血尿毒综合征(aHUS)、C3肾小球病(C3G)、免疫复合物膜增生性肾小球肾炎(IC-MPGN)等肾病适应症。
本次公布的是朗来科技MY008211A的一项多中心、开放标签、剂量探索的II期临床研究(NCT06050226),评估MY008211A片单药治疗未接受补体抑制剂治疗的阵发性睡眠性血红蛋白尿症患者中的疗效及安全性。符合临床研究条件的患者纳入到本研究的400mg BID、600mg BID与800mg QD剂量组中。研究主要终点为第84天时,血红蛋白(Hb)浓度相较于基线增加≥20g/L的受试者比例,Hb浓度相比基线的变化为次要终点。
自2023年8月至2024年4月,共入组34例PNH患者,其中15例进入400mg BID组,9例进入到600mg BID组,10例进入到800mg QD组中。患者的平均年龄为39.5岁,其中女性19例(55.9%)。所有34例患者均纳入了疗效分析和安全性分析。
在没有输血的情况下,在第84天,所有剂量组34例受试者(100%)全部达到Hb浓度相较于基线增加≥20g/L的主要终点。400mg BID组、600mg BID组和800mg QD组的血红蛋白水平均较基线明显增加,分别增加44.7g/L、43.6g/L和42.4g/L。400mg BID组、600mg BID组和800mg QD组的乳酸脱氢酶(LDH)相比基线明显下降,D84时,分别下降87%、87%和81%。
所有患者在MY008211A片治疗后均无需输血。
MY008211A治疗过程中未发生死亡,未发生治疗相关的SAE,无提前终止,常见AE为头痛,绝大多数为轻度。
在这项多中心、开放标签的II期研究中,安全性和耐受性良好,3个剂量组的MY008211A治疗12周,所有患者Hb均比基线增加≥20g/L,包括FACIT-疲劳评分在内的次要研究终点的改善程度在不同剂量组表现相似。
同类药盐酸伊普可泮(Iptacopan),于今年4月,在国内获批用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。
(对比LNP023-3期)
目前公布的数据来看,朗来科技的MY008211A片在12周时在所有患者中均达到了血红蛋白(Hb)浓度相较于基线增加≥20g/L的主要终点,MY008211A片的早期数据显示有效性优于盐酸伊普可泮(92.2%),期待后续MY008211A片PNH适应症2个III期的临床结果。
















